いきなりですが、ギブズエネルギーの使い勝手と、その簡単な計算に慣れてもらいます。
化学反応では、物質(A)が持つ自由エネルギーを使って、化学結合を組みなおして、別の物質(B)が生成されます。化学反応を定量的に理解するため、物質(A)と(B)のエネルギー差を計算したり、物質がもつエネルギーの内訳を考えたりします。
まず、物質が持つ総エネルギーをエンタルピーと呼びます。それには、仕事につかえるエネルギー(自由エネルギー)と仕事に使えないエネルギー(束縛エネルギー)があります。
【物質が持つ総エネルギー:エンタルピー】 =
【仕事に使えるエネルギー:ギブズ自由エネルギー】
+ 【仕事に使えないエネルギー:束縛エネルギー】
自由エネルギーにもいくつか種類があるのですが、ここではギブズ自由エネルギーを扱います。
ある物質のギブズ(自由)エネルギーとは、構成元素からその物質を合成するのに必要なエネルギーです。その物質をどれくらいの濃度でつくるのか、温度によっても必要なエネルギーは異なるので、以下のように定義します。
元素A, B, C,,,,で構成される物質(ABC,,,)について、
【ある状態の(任意の状態にある)物質(ABC,,,)のギブズ自由エネルギー】=
【標準状態(25℃, 1気圧)において、構成元素A, B, C,,,から物質(ABC,,,)を1mol合成するのに要するエネルギー】
+
【標準状態にある物質(ABC,,,)から、任意の状態(異なる量(圧力・濃度)や温度)に変化させるのに要するエネルギー】
右辺第一項: 標準状態(25℃, 1気圧)において、構成元素A, B, C,,,から物質(ABC,,,)1molを合成するのに要するエネルギーのことを、物質(ABC,,,)の標準生成ギブズエネルギーといいます。
もう少し丁寧に標準生成ギブズエネルギーを説明: 標準状態(25℃、1気圧)において、ある元素が単体で安定に存在する状態を基底(自由エネルギーゼロ)として、その単体(自由エネルギーゼロ)から物質を合成するのに要する自由エネルギーのことです。エネルギーの高低を論じるときは、どこかを基底(ゼロ)に定めなくてはならないので、標準状態で単体として安定に存在するときの各元素の自由エネルギーをゼロと定めました。水溶液中のイオン成分については、H+の標準生成ギブズエネルギーをゼロと定めています。
なにやら、わけわからないでしょうが、例題を解いて慣れてゆきましょう
【例題】 水素分子(H2)と酸素分子(O2)から水分子(H2O)が生成されるときの、物質に含まれるエネルギーの内訳を示す。下図を軽く眺めてから、下にスクロールしてすすんでください。
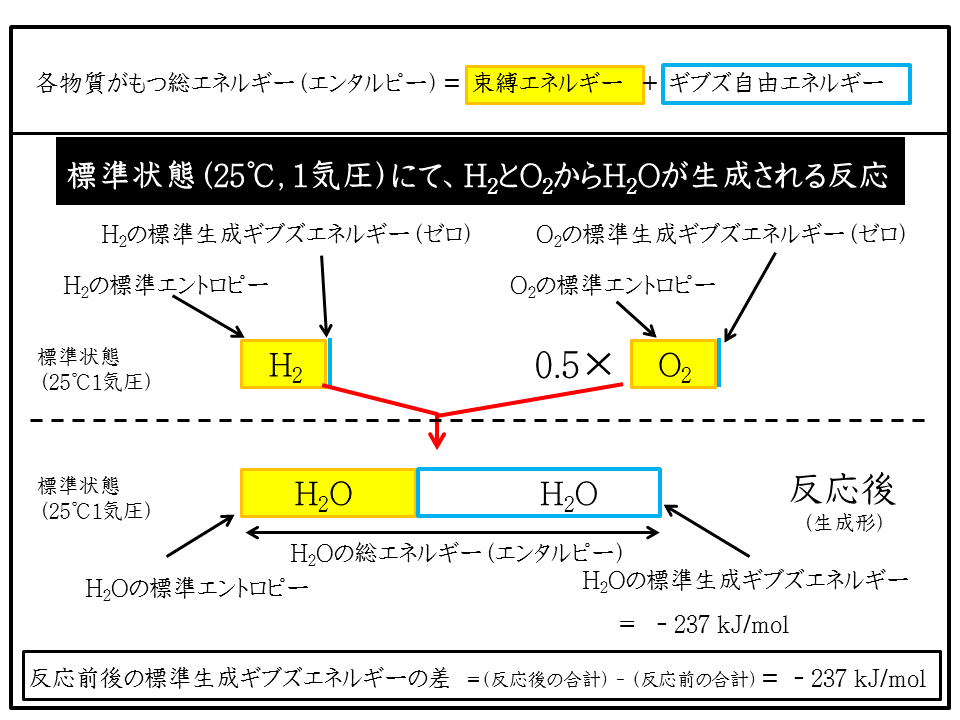
水分子(
H2O)であれば、構成する元素は水素
(H)と酸素
(O)です
。それぞれの元素が単体で安定にある状態は、水素分子(H2)と酸素分子(O2)です。したがって、反応前の水素分子(H2)と酸素分子(O2)の標準生成ギブズエネルギーはともにゼロです。標準状態において、H2とO2が反応して1molのH2Oを生成するのに要する自由エネルギーがH2O(液体)の標準生成ギブズエネルギーで-237 (kJ/mol)です。
上の絵や先に説明したように、ある物質がもつ総エネルギーをエンタルピーと呼び、その内訳として、仕事として取り出せない「束縛エネルギー(エントロピー)」と仕事として取り出し得る「ギブズ自由エネルギー」があります。
そして、反応前後のギブズエネルギーの合計差が化学結合を組み直すのに使われるのです。
(反応前後の総エンタルピーの差が、反応熱として外界に放出される。これについても、あとで詳しく説明する)
(ちなみに、束縛エネルギー(エントロピー×温度)は物質の集合状態を表すエネルギーで、絶対零度のときに、理論上、各物質の束縛エネルギーがゼロになります。したがって、標準状態(25℃)にある物質の束縛エネルギーをゼロとは定めません。 上の絵にあるように、標準状態で安定に存在する単体であっても束縛エネルギーは存在し、そのとき(標準状態)のエントロピーを標準エントロピーと呼びます。各物質について、標準生成ギブズエネルギーと標準エントロピーの値が化学便覧などでまとめられています。 また、標準生成エントロピーとは、前項絵において、反応後のH2Oの標準エントロピーから、反応前の単体(O2とH2)の標準エントロピーを差し引いたものです。 今の段階では、エントロピーについては理解しなくてもよいです。あとのコースで説明します。)
「こんなの、生物には関係ないっしょ、メンドクセー」という声が聴こえてきます。次のコースにて、標準生成ギブズエネルギーを使って、生物が呼吸によって得られるエネルギーを簡単に計算してみましょう。