エントロピー変化の計算例
気体A(1mol)が1m3の容器に入っている。隣り合わせに、気体B(1mol)が1m3の容器に入っています(下の絵)。容器ABの間仕切りを外してAとBの気体を混合したときのエントロピー変化を計算します。
気体Aにとっては存在する体積が1→2m3、気体Bにとっても体積が1→2m3に増えました。このとき、気体Aと気体Bについて、それぞれのエントロピー変化(SA, SB)は、
SA = 1・8.31・Ln(2/1) = 5.76
SB = 1・8.31・Ln(2/1) = 5.76
です。系全体のエントロピー変化は、
SA + SB = 11.52 (J/K) です。
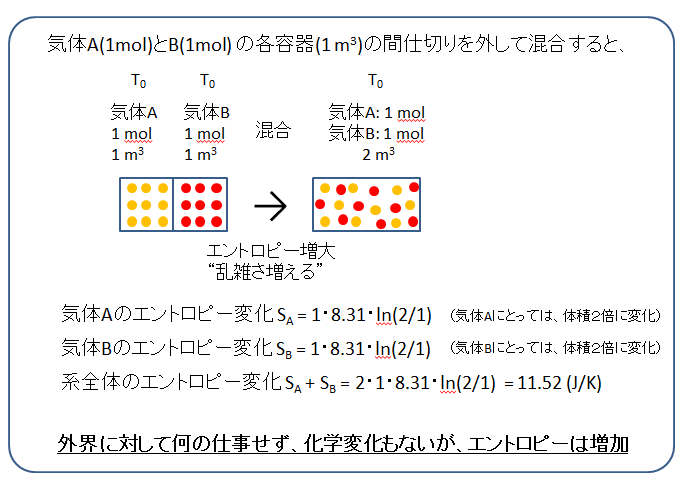
接する空間の間仕切りを外して、それぞれの気体を混合しただけです。
外界に対しては
何の仕事もせず、化学変化もないが、エントロピーは増大しました。