再び、
O2と
H2から
H2Oが生成される反応を例に、それぞれの物質がもつエネルギーの内訳を考えます
。
まず、原形のH2が持つエネルギーの内訳を下図に示します。
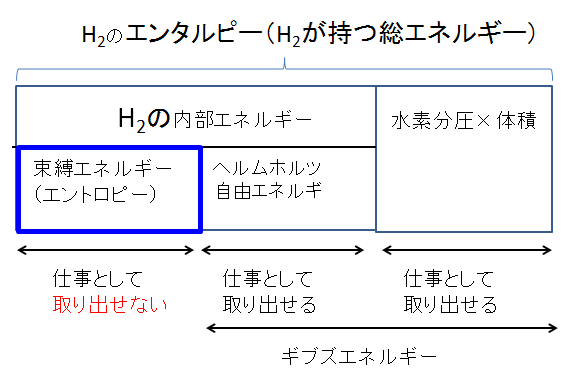
物質が持つ総エネルギーをエンタルピーと呼びます。先のコースでは、その内訳として、束縛エネルギー(エントロピー×温度)とギブズエネルギー(G)があると述べました。
上図でも、そのように記述していますが、新たに内部エネルギーとヘルムホルツ自由エネルギー、圧力×体積が加わりました。圧力×体積は体積膨張による仕事で、これも自由エネルギーです。
上の図によると、内部エネルギーには、仕事として取り出せる“自由エネルギー”と、仕事として取り出せない“束縛エネルギー”が内在します。自由エネルギーの総和がギブズ(自由)エネルギーです。
何がなんだかわからないでしょう。
とくに、ここで出てきた束縛エネルギー(エントロピー)こそ、熱力学の
挫折ポイントの一丁目一番地です。 遠回りになりますが、まずはエントロピーを攻略しましょう。