化学平衡の基本式を使った練習問題を解いてもらいます。
練習問題) 塩化ナトリウムの溶解平衡濃度を、熱力学定数から求めてください。(酸化還元反応ではありません)
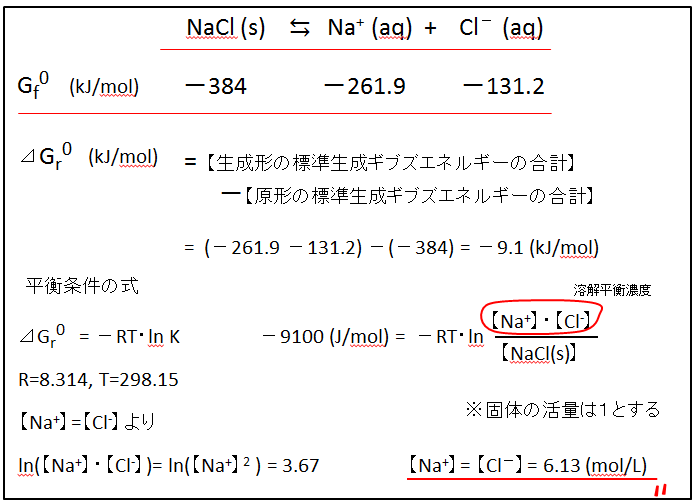
【手順】
① 溶解平衡の反応式を記す
② 各物質の下に、標準生成ギブズエネルギーを記す(一覧表より読み取ってください)
③ 【生成形の合計エネルギー】-【原形の合計エネルギー】を求める。
キロ(k)を外すため1000倍しておきます。
④ 平衡条件の式(エネルギー差= -RTLn K)に代入します。
⑤ K=(生成形の濃度積)/(原形の濃度積)
ただし、溶液反応における固体の濃度は1とします。塩化ナトリウムの飽和溶液の濃度を求めるので、NaClの結晶(固体)が溶け残っている状態です。[NaCl] = 1 とします。
⑥ NaClが溶けると、Na+とCl-は同じ量だけできるので、][Na+] = [Cl-] とおいて、[Na+] を求めます。
※ギブズエネルギーの単位では、kJ/molとキロ(k)がついているのに注意してください。
塩化ナトリウムの溶解平衡濃度を実験的に求めることは容易です。塩化ナトリウムの結晶を水に入れてよく混ぜ、一晩放置しても結晶が溶け残っている状態の溶液が飽和溶液です。その飽和溶液を一定量採取し、蒸発乾固させ、残差物の重量を測定すれば、飽和濃度を求められます。ただし、飽和溶液はイオン強度が大きいから活量係数を考慮する必要あります。