反応系の原形にはH2とO2、生成形にはH2Oが存在します(下図)。生成形と原形を含めた反応系の束縛エネルギー変化は、T・⊿S【生成形】―【原形】です(下図では、T・⊿S系と表示)。 この反応が起こると、反応熱(⊿Q)が外界に伝わります。外界を含めて考えると、外界は熱⊿Qをうけとっているので、外界のエントロピーは⊿Q/T増えました。 ただし、外界は十分に大きく、反応前後で外界を含めた温度Tは変わりません。
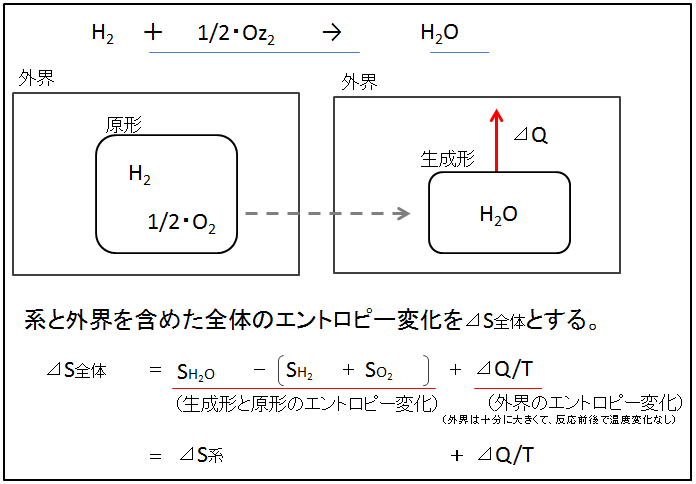
反応系と外界を含めた全体のエントロピー変化を⊿S全体とすると、
⊿S全体 = ⊿S【生成形】-【原形】 + ⊿Q/T
が成り立つ。この外界を含めた系は十分大きくて温度変化がないので、断熱系とみなせる。つまり、この系では、エントロピーが増大(
S全体>
0 )するのです。
エントロピー増大の条件を課すと、
⊿S全体 = ⊿S【生成形】-【原形】 + ⊿Q/T > 0 ①
これに、先に求めた以下の式を代入する。
⊿H【生成形】-【原形】=T⊿S【生成形】-【原形】+ ⊿G【生成形】-【原形】
→ T⊿S【生成形】-【原形】=⊿H【生成形】-【原形】- ⊿G【生成形】-【原形】
→ ⊿S【生成形】-【原形】=⊿H【生成形】-【原形】/T- ⊿G【生成形】-【原形】/T
①の⊿Sに代入
⊿H【生成形】-【原形】/T
- ⊿G【生成形】-【原形】/T +⊿Q/T > 0 ②
エンタルピー変化と反応熱(-⊿Q)が等しく(⊿H【生成形】-【原形】=-⊿Q)、T>0なので、
(-⊿Qのマイナス符号は、系からみると熱を失っているから。)
②は、⊿H【生成形】-【原形】/T
- ⊿G【生成形】-【原形】/T -⊿H【生成形】-【原形】/T > 0
つまり、
⊿G【生成形】-【原形】< 0 の向きに反応が進む
化学反応が平衡にある条件とは、反応系と外界を含めたエントロピーが変化しない場合である。つまり、以下の条件が成り立ちます。
次のコースでは、この条件式と熱力学関数を合わせて、先に扱った、化学平衡の条件式を導きます。