二つの水槽にそれぞれ、亜鉛(Zn)と銅(Cu)の電極があり、2 molずつのZn2+,
Cu2+, SO42-のイオンが水に溶けています。
(SO42-があるのは、ZnSO4やCuSO4を溶解させたからです)
例題1-1)
それぞれの電極の半反応の標準電極電位を求めてください。
解答
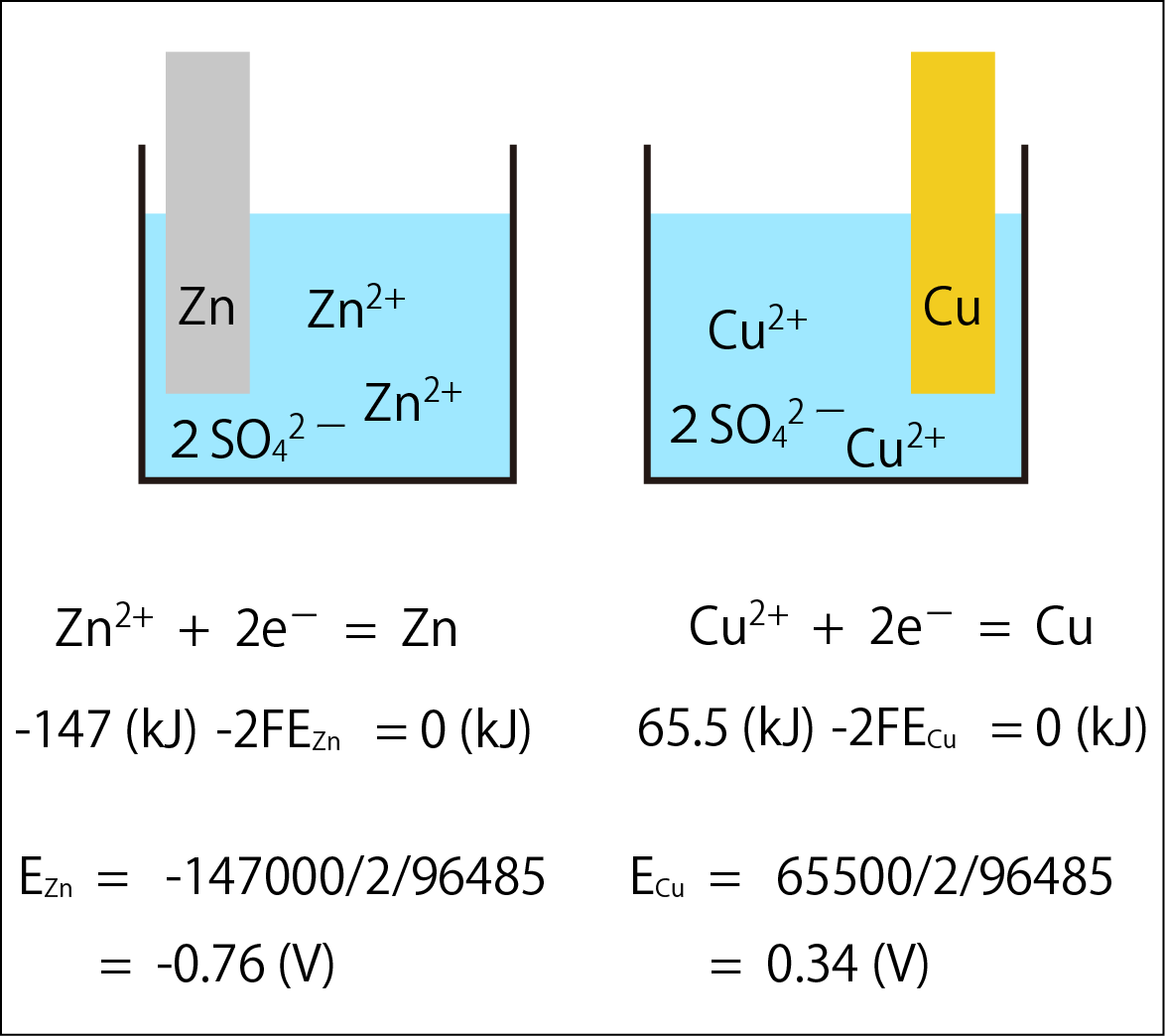
上の図では、銅(Cu)と亜鉛(Zn)が電子を放出する半反応と各物質の標準生成ギブズエネルギー、電子のエネルギーを記しました。これらの半反応で生ずる標準電極電位は、EZn = -0.76 (V)、ECu
= 0.34 (V) と計算されます。
これらの電極がつながって回路になっていれば、電子は電位の低い亜鉛から、電位の高い銅に流れるかもしれません(下の図)。
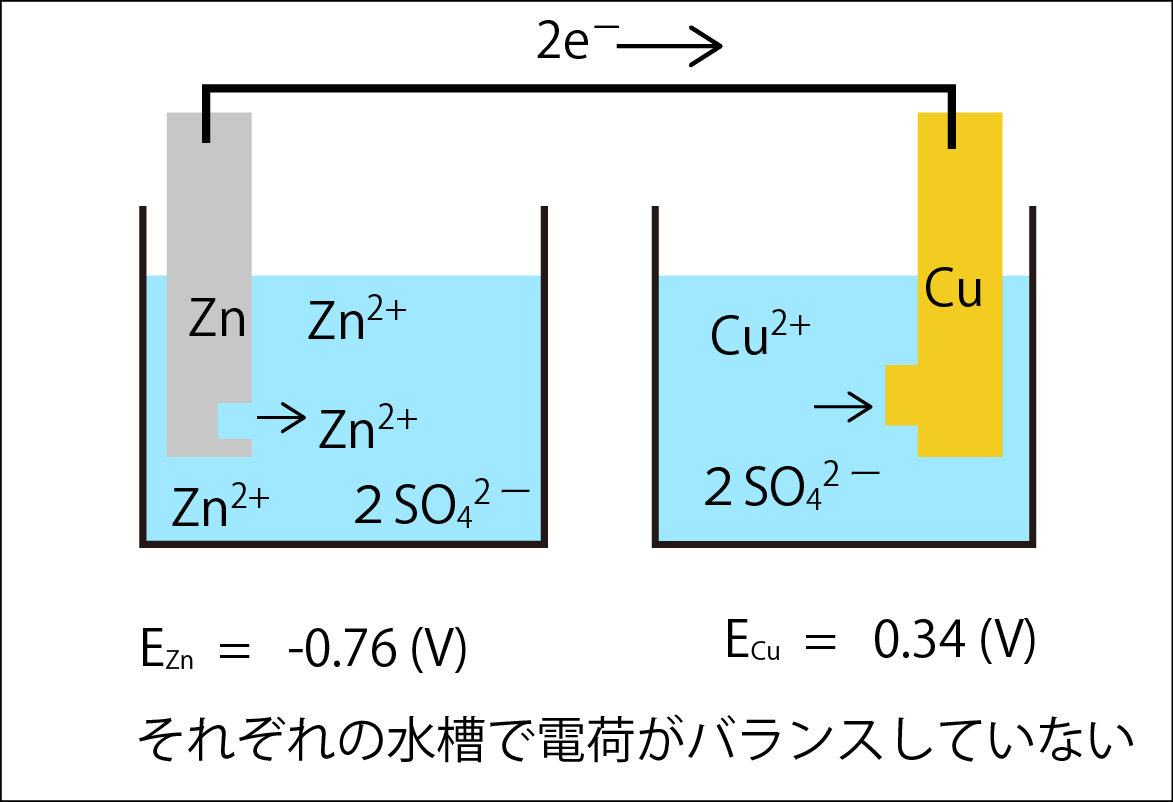
残念ながら、これでは回路になっていません。このままでは亜鉛の水槽では陽イオンが過剰、銅の水槽では陰イオンが過剰になり、電荷バランスが崩れてしまい、反応を進めることができない。
そこで、回路とするため、両水槽にイオンを供給するための塩橋を取りつけました。
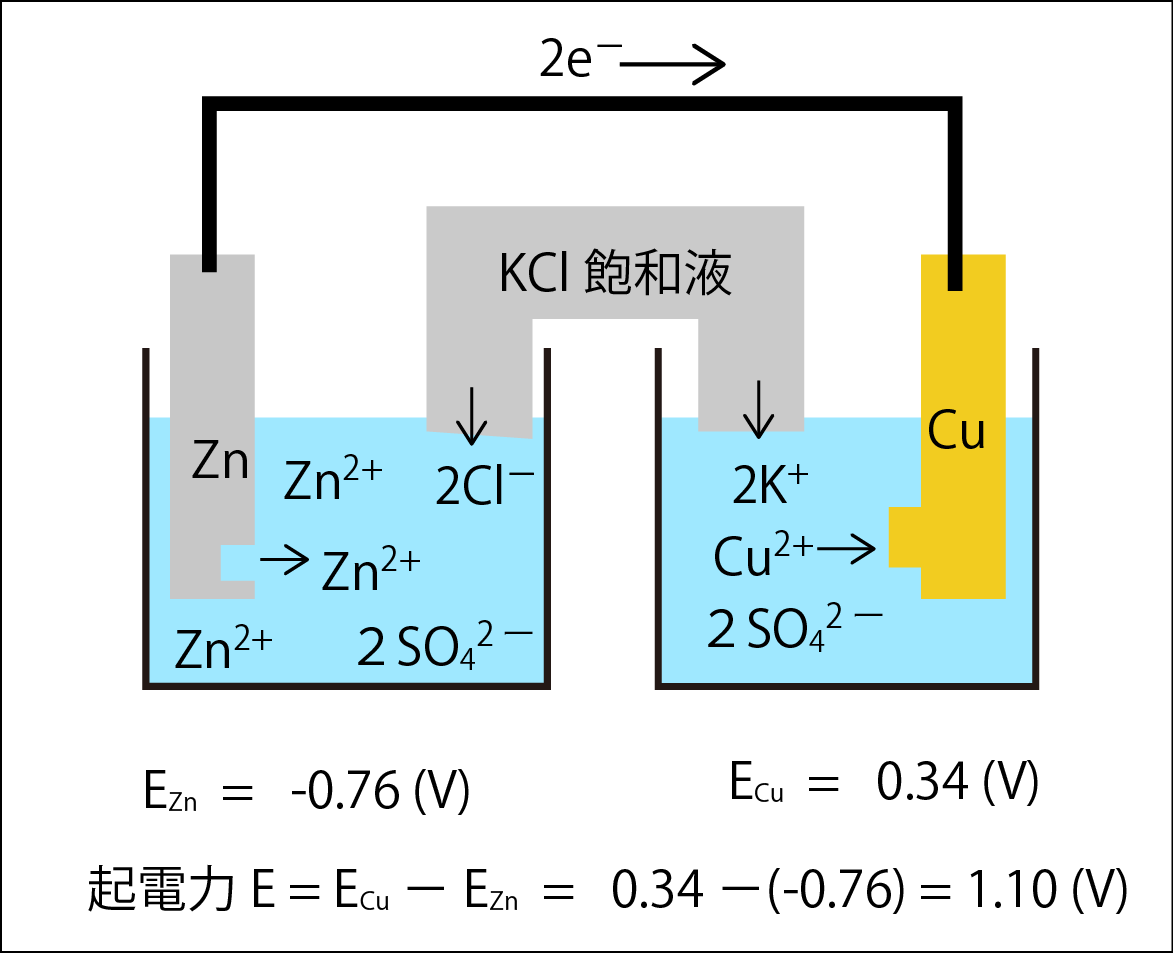
塩橋にはKCl飽和溶液が入っていて、両水槽を電気的につなげ、電荷バランスをとるようにK+とCl-を供給します。その際、両水槽間でZn2+とCu2+がまざらないようにしています。このとき、両水槽間の標準電極電位の差は1.10(V)となります。
例題2) 回路を作った初期の銅と亜鉛イオンの濃度を、
[Cu2+]=
[Zn2+] = 0.1 (mol/L)とします。この反応が進んで、
[Cu2+]=
0.05 (mol/L)、
[Zn2+] = 0.15 (mol/L)になりました。起電力がどのように変化するか、ネルンストの式を用いて計算してください。同様に、[Cu2+]=0.001 (mol/L)と[Zn2+] = 0.199 (mol/L)のときの起電力も求めてください。
解答
ネルンストの式に、未知の[Zn2+]や[Cu2+]を代入します。標準電極電位は、例題1で求めた値です。
EZn = -0.76 -
RT/(2F)・Ln([Zn]/[Zn2+])
ECu = 0.34 -
RT/(2F)・Ln([Cu]/[Cu2+])
固体の活量は1だから、[Zn]=[Cu]=1
両半反応の電位差(起電力)Eは、
E = ECu – EZn = 0.34 –
(-0.76) -RT/(2F)・Ln[Zn2+]/[Cu2+]
と表されます。
先に求めた起電力1.10(V)とは、[Zn2+]/[Cu2+]=1のときです。
回路を作った初期は[Cu2+]=[Zn2+]
= 0.1 とします。この反応が進んで、[Cu2+]=0.05、[Zn2+] =
0.15になると、起電力Eは、
E = 1.10 -RT/(2F)・Ln(0.15/0.05) = 1.09 (V)
となります。
さらに電池反応が進んで[Cu2+]=0.01、[Zn2+] = 0.19になると、E = 1.10 -RT/(2F)・Ln(0.19/0.01) = 1.062 (V)、[Cu2+]=0.001と[Zn2+] =
0.199でE = 1.032 (V)、[Cu2+]=0.000001と[Zn2+] =
0.199999でE = 0.94 (V)です。電池残量がゼロになる直前まで、当初の起電力(1.10 V)に近い値が維持されのです。
つぎのコースでは、物理化学の基礎を学ぶ。化学平衡式やネルンストの式で、-Ln(生成形の濃度積/原形の濃度積)が出てくることを導きます。