再び、水酸化鉄が溶解する半反応式とネルンストの式を記します。
水酸化鉄の溶解(半反応式): Fe(OH)3 + 3 H+
+ e- = Fe2+ + 3
H2O
ネルンストの式
E = E0 -RT/(F)・Ln { [Fe2+] /( [H+]3
・[Fe(OH)3])
=
0.969 -
0.024387・Ln{ [Fe2+] / [Fe(OH)3]} - 0.168459pH
(物理化学の約束として、固体(Fe(OH)3)の溶液反応において、その固体は十分量あると考えて、固体濃度=1 となります)
Fe2+ とFe(OH)3 の存在比を分ける条件 [Fe2+] / [Fe(OH)3] =1 のとき、
([Fe(OH)3] =1 (mol/L)とするので、 [Fe2+] = 1 (mol/L)のとき)
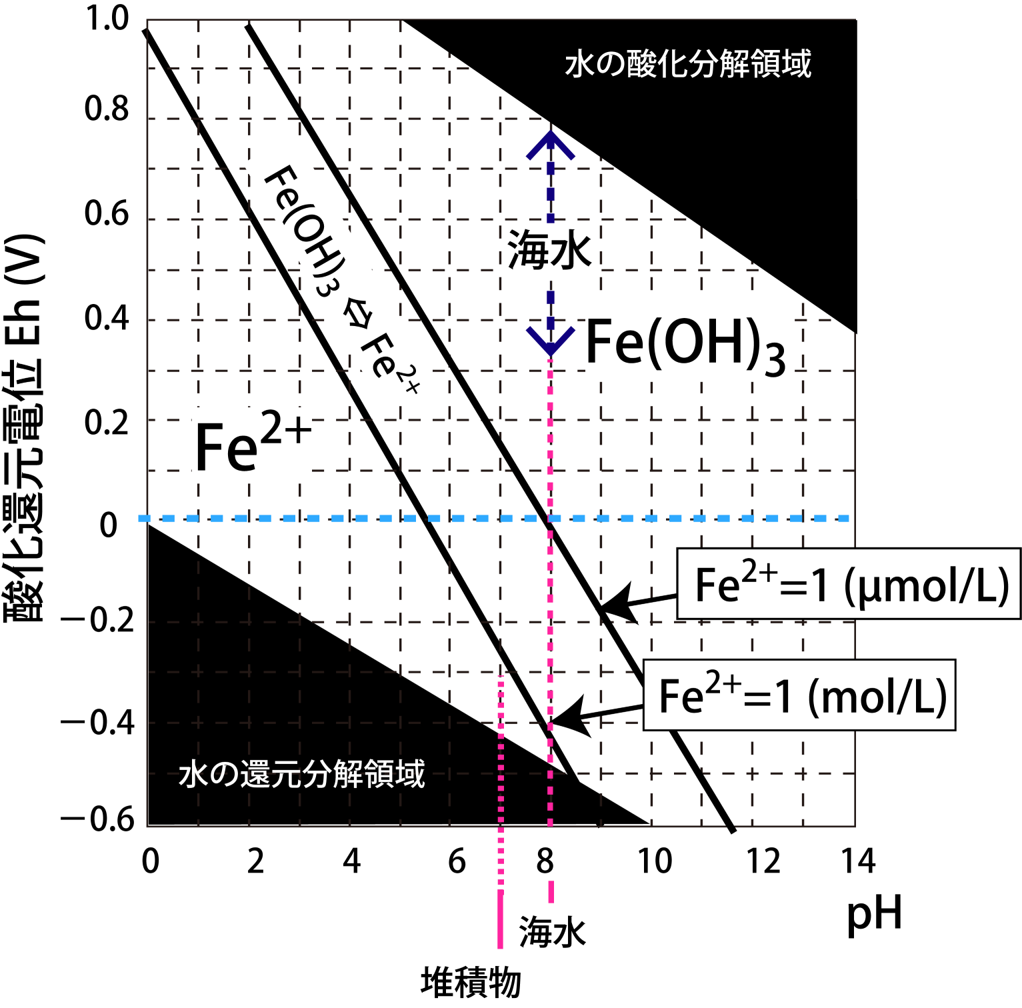
E = 0.969 - 0.168459pH となります。
横軸にpH、縦軸にEをとって、この関係式を下の図に描きました。
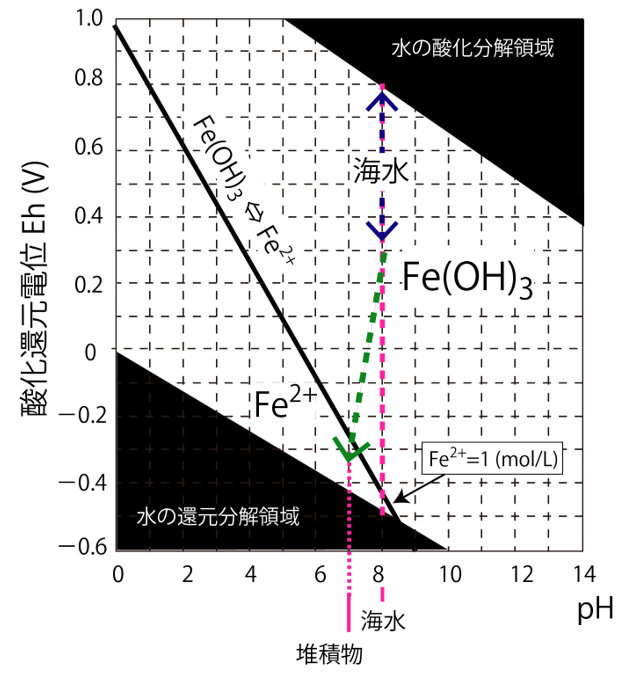
境界条件(Fe(OH)3 ⇔ Fe2+)の黒太線より上側の領域では固体のFe(OH)3が存在することを意味し、Fe2+は1
mol/L以下で溶解平衡に達していることを意味します。
それでは、[Fe2+] < 1 mol/L ではどのようなラインになるでしょうか。
溶解平衡濃度 [Fe2+] = 1 µmol/L のときのラインを下の図に加えました。大きくシフトしているのがわかります。