アルカリ度と炭酸成分
海水には、強電解質のイオン成分が豊富に溶けています。強電解質のイオン成分とは、水中で完全に電離している成分のことです。例えば、塩化ナトリウム(NaCl)が水に溶けると、溶けたNaとClは全て正と負のイオン(Na+とCl-)として電離(正と負の電荷を分かちあって離れて存在)しています。
海水の強電解質の正イオンと負イオンの総電荷量の差をみると、正イオンのほうが約2.3 mmol kg-1だけ電荷が過剰に存在します。この「強電解質正イオンの過剰分の電荷量」をアルカリ度(Alkalinity)といいます。
つまり、アルカリ度 [Alk] は以下の式であらわされます。
[ Alk ] =[Na++K++2Mg2++2Ca2+ + ,,,] - [Cl-+Br-+2SO42-+NO3- + ,,,] (= 2.3 mmol kg-1 )
海水自体は電気的に中性なので(つまり、正電荷量と負電荷量が等しく、帯電していない※)、弱電解質の負イオンが電荷の過剰分を打ち消さなくてはなりません。海水のアルカリ度を保つための弱電解質イオンは、炭酸水素イオン、炭酸イオン、ホウ酸イオン、水酸化物イオン、水素イオンです。これらの総電荷量がアルカリ度に等しいです。
上の図に、アルカリ度を保つ弱電解質成分と、それぞれの割合を示しました。アルカリ度の96%は、炭酸系イオンによって保たれます。
※ 海水は地球に接しているので、正or負に帯電することはありません。仮に電荷が与えられても、そのまま地球に吸い取られます。いっぽう、空に浮かぶ雲粒は帯電して、ときおり稲妻として地球に電荷が吸い取られます。
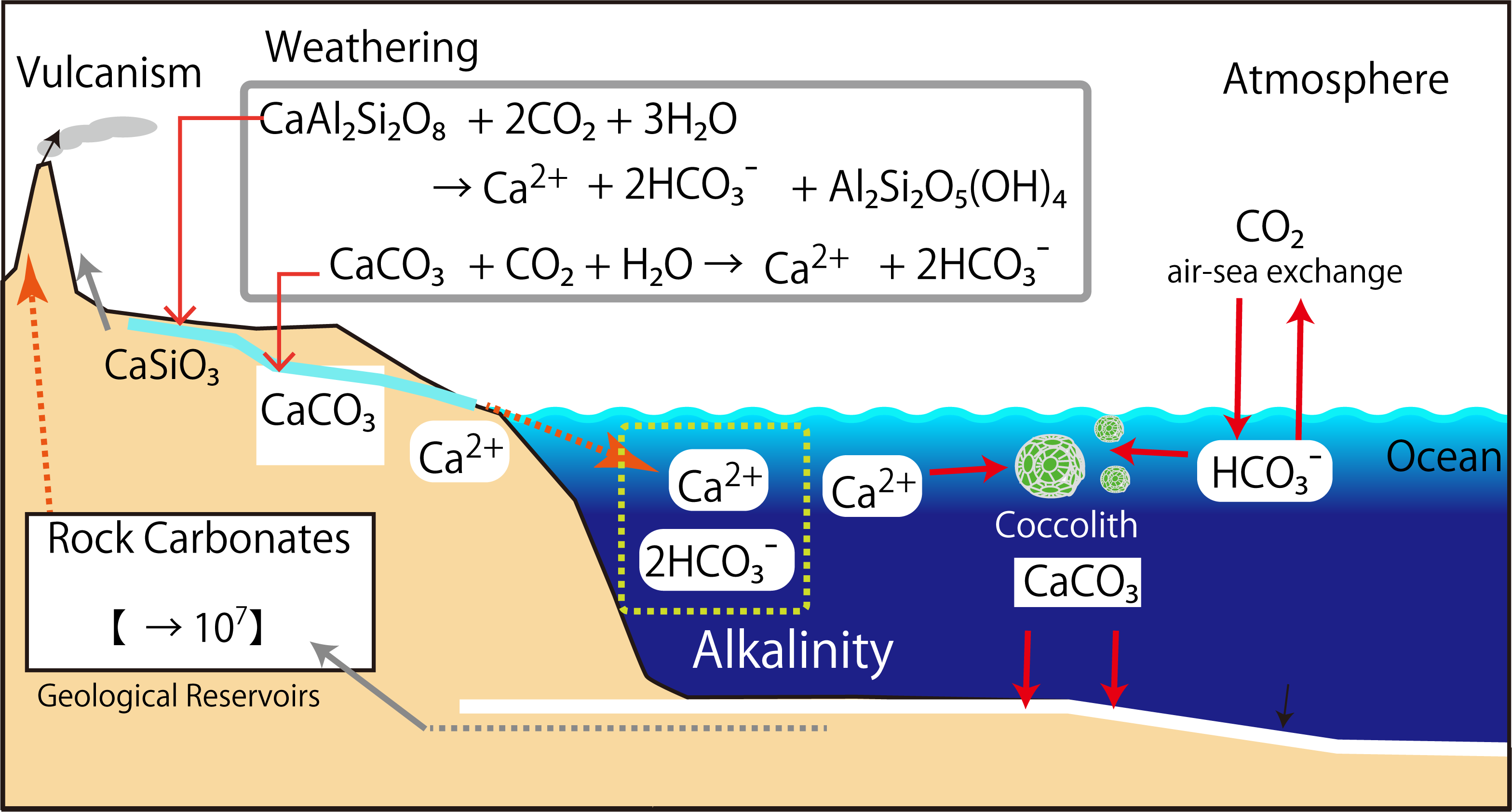
そもそも、なぜ強電解質正イオンが過剰なのでしょうか。おそらく、地球誕生初期には小惑星や隕石が地球に衝突して、軽元素(水素や炭素、酸素、硫黄、塩素、、)の多くは蒸発したでしょう。炭素と酸素がくっつけば二酸化炭素、水素と酸素で水、硫黄と水素で硫化水素、塩素と水素で塩酸、になります。地球の初期大気と海洋には酸性物質が豊富に含まれており、それらが岩石中の陽イオンを溶出させて海水の塩の元になったと考えられます。強酸のHClやH2SO4の他に、弱酸の炭酸(H2CO3)が玄武岩を溶かすのに大きな役割を果たします。下の絵のように、玄武岩が溶けると、Ca2+とHCO3-が生まれます。HCO3-の一部が解離してCO32-になり、Ca2+とくっ付いてCaCO3になります。海水が酸性(pH7以下)のうちは、炭酸イオンの平衡はH2CO3やHCO3-に偏っています。つまり、Ca2+が溶けだしても、なかなかCaCO3にならず、海水にCa2+が残ります。現在、海水のpHが8になり、現在のアルカリ度に至っています。現在では河川を通じて海洋にCa2+が供給されて、量的には平衡が保たれています。(アルカリ度の成因については、文献を調べて、より確かな情報に更新する予定です)
現大気の二酸化炭素分圧は0.00038気圧(= 1気圧×380ppm)ほどですが、 雨粒にCO2が溶けて弱酸のH2CO3ができます。弱酸性(pH5.6)の雨水が現在でも岩石を徐々に溶かしているのです。(雨水のpHは後の練習問題で解いてもらいます)
現在は、以下のような状態で海水のアルカリ度が保たれています。海洋での炭酸カルシウムの形成は、生物の殻形成がほとんどだと言われています。