化学反応の前後で物質が持つエネルギーの内訳が変わります。これらの差が何を意味するのかを学んでください。
標準状態(25℃、1気圧)において、水素と酸素から水を生成する反応前後のエネルギーの内訳を下図に示します。
反応前(原形)は、H2とO2の二成分が存在して、それぞれの物質のエンタルピー(物質がもつ総エネルギー)をHH2、HO2と記しました。エンタルピーの内訳は、内部エネルギー(U)とPVです。ここで注意したいのは、このPは全圧(1気圧)ではなく、各成分の分圧です。各成分の分圧の合計(全圧)が標準状態では1気圧です。(柔らかいビニール袋に、水素ガスと酸素ガスを注入した状態を想像すればよい)
水素と酸素が同じ空間に存在するのだから、体積Vは両成分共通になります。内部エネルギーは、束縛エネルギーとヘルムホルツ自由エネルギーで分配されています。ヘルムホルツ自由エネルギー(F)とPVを合計したものが、ギブズエネルギー(G)です。
原形の合計エンタルピーは、【 HH2+HO2 】で表され、同様に、原形の合計ギブズエネルギーは、【 GH2+GO2 】で表されます。
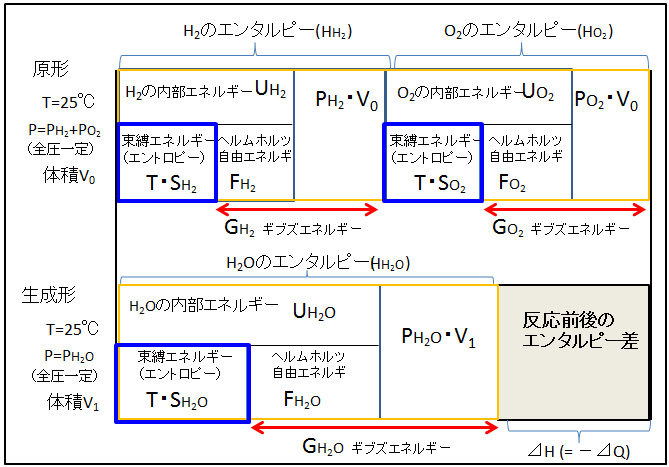
原形の水素と酸素が反応すると、水(H2O)が生成されます。
・生成形の合計エンタルピー:HH2O
・合計ギブズエネルギー: GH2Oです。
・生成形と原形のギブズエネルギーの差(⊿G【生成形】-【原形】): GH2O-(GH2+GO2)
・生成形と原形の束縛エネルギー差(T⊿S【生成形】-【原形】): T・SH2O-(T・SH2+T・SO2)
・生成形と原形のエンタルピー差(⊿H【生成形】-【原形】): HH2O-(HH2+HO2)
さて、原形と生成形の合計エンタルピーに違いが生じています。つまり、水素と酸素が反応して水になると、反応系の総エネルギーは減少してます。つまり、外界に熱として逃げているのです。⊿H【生成形】-【原形】が熱量(⊿Q)に等しい。これが反応熱です。系からみると熱を失っているので、マイナス符号がつきます。