エントロピー増大の法則を説明します。
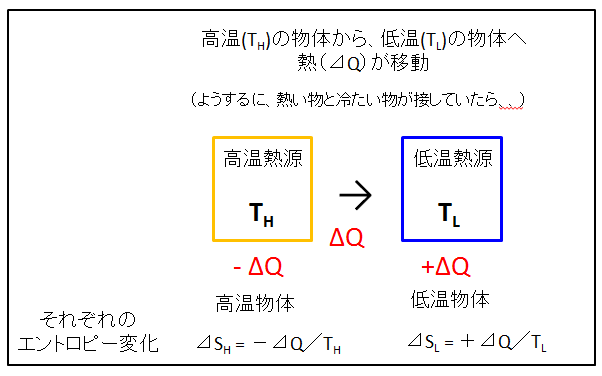
高温(TH)の物体と低温(TL)の物体が接していれば、高温側から低温側へ熱(⊿Q)が移動しました。それぞれの物体のエントロピー変化を計算します。
高温物体からみれば、熱を失っているので、熱の移動量は-⊿Q
低温物体から見れば、熱を受けとっているので、熱の移動量は+⊿Q
したがって、
低温物体のエントロピー変化(⊿SL )
⊿SL = +⊿Q/TL
と表されます。
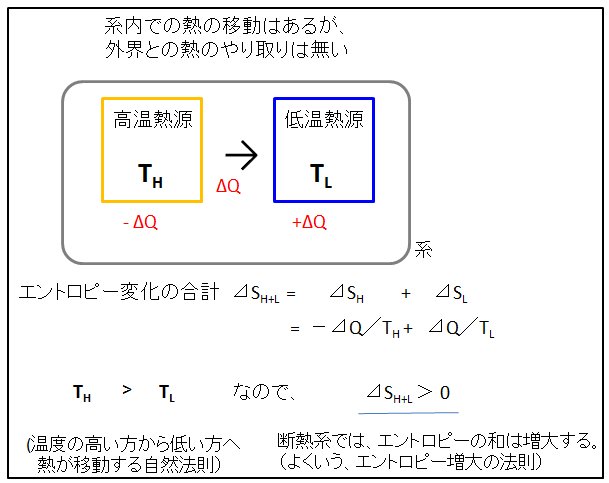
つぎに、高温物体と低温物体を一緒にスッポリ断熱壁で覆ってしまうと(下図参照)、外界との熱の出入りの無い断熱系とみなせます。そのとき、系内にある高温物体から低温物体に熱が移りました。
系内のエントロピー変化の合計(⊿SH+L)は以下のように計算されます。
⊿SH+L = ⊿SH = + ⊿SL = -⊿Q/TH + ⊿Q/TL
TH
> TL だから、⊿
SH+L > 0 となります。
つまり、断熱系では、エントロピーの和が増大します。これがよくいう、
“エントロピー増大則
”の一例です。
※ 化学反応が進む向きは、実験系と外界を含めた系を断熱系とみなして、そのエントロピーが増大する向きになります。化学反応が止まったようにみえる平衡状態は、エントロピー変化がない条件、と定められます。化学反応を理解するには、エントロピーの理解が大事でです(後のコースで説明します)。