エントロピーの説明①
100gの水が入った二つのビーカー。片方は凝固点ギリギリの0℃(下図A)、もう片方はアツアツの90℃(下図B)。これらのビーカーに沸点ギリギリの100℃の熱湯20gを注ぎました。(A)の方は、120gで約16℃の水、(B)は120gで約92℃のアツアツのお湯になりました。
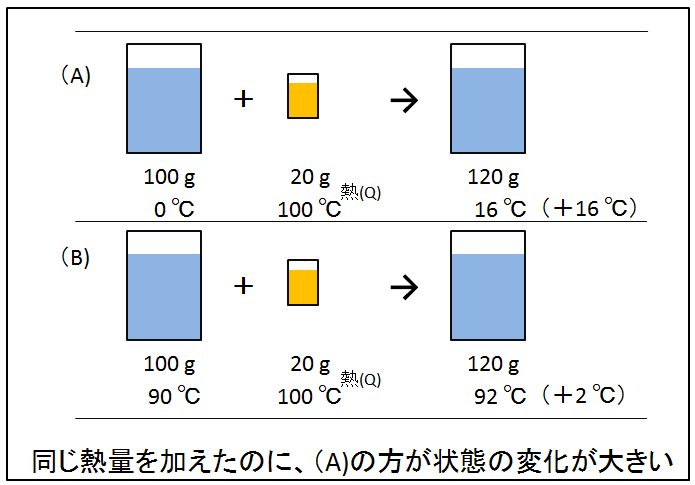
同じ熱量を加えたのに、(A)は+16℃も上昇、(B)は+2℃だけ上昇しました。(A)の方が状態の変化が大きい。(A)と(B)の状態変化を比べるには、何か尺度が必要でしょう。両者で違うのは元の温度。元の温度が低い方が状態の変化が大きいのです。
そこで、加えた熱量(⊿Q:ジュール)を元の温度(T:ケルビン)で割って、状態の変化量(⊿S)を定義します。
このSを、エントロピーと呼び、⊿Sをエントロピー変化といいます
(【エントロピー変化⊿S】×【温度T】が系に加えられた熱量(⊿Q)に等しく、【エントロピーS】×【温度T】が束縛エネルギーになります。)
エントロピーを定義されても、いまいちピンときませんね。巷の教科書には、“エントロピーとは乱雑さの度合い”とか説明されていて、余計にわからなくなります。
いくつか例を示すので、エントロピーのイメージを持ってください。