//////////////// 化学平衡の基本式 /////////////////////////
以下の反応を考えます。
化学種A、B、 ・・・が反応して、
化学種X、Y、 ・・・を生成する。
なお、
化学種Aはaモル、Bはbモル、、、
化学種Xはxモル、Yはyモル、、、 の比率で反応する。
これを反応式で記すと、
【原形】 【生成形】
aA +
bB + … ⇆ xX
+ yY + …
反応前の系を「原形」、反応後の系を「生成形」といいます。
A, B, …からX, Y, …を生成する反応速度と、X, Y, …からA, B, …を生成する反応速度が等しいとき、この反応は平衡状態にあるという。
平衡状態においては、質量作用の法則により次の関係が成立する。
つまり、
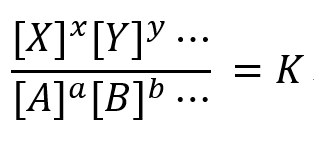
Kを平衡定数とよび、この関係を質量作用の法則という。
[A],
[B], [X], [Y]はこの反応の平衡濃度、a, b, …, x, y, …は反応モル比です。
このKは、固体の溶解反応であれば、溶解平衡定数とか溶解度積と呼ばれたり、水に溶けると水素イオン(H+)や水酸化物イオン(OH-)を解離する反応であれば、酸解離定数とよばれます。
ここで、
原形を構成する各物質の標準生成ギブズエネルギーの合計:ΣGf0原形
生成形を構成する各物質の標準生成ギブズエネルギーの合計:ΣGf0生成形
として、
反応前後における(生成形と原形を構成する物質の)標準生成ギブズエネルギーの合計差をとると、
⊿∑Gf0生成形-原形 = ΣGf0生成形 - ΣGf0原形
この反応が平衡状態にあれば、以下の関係を満たす。
⊿∑Gf0生成形-原形 = -R・T・lnK (A)
気体定数R = 8.314、Tは絶対温度
(“ln”は、logeのことである)
Kは、質量作用の法則による平衡定数と同じで、
K = 【生成形の活量の積】/【原形の活量の積】
先の説明では、【濃度積】と記しましたが、正確には【活量積】です。繰り返しになりますが、平衡状態における定数(K)なので、【活量の積】は平衡状態にあるときの活量の積です。
このように、熱力学定数(標準生成ギブズエネルギー)から求められるKのことを、熱力学的平衡定数と呼びます。
なお、活量の取り扱いについては以下に従います。
・ 理想溶液のモル濃度a (mol/L)を活量aとする。
・ 理想気体の分圧b (atm)を活量bとする。
・ 電子の活量を1とする。
・ 水溶液中で水分子が反応に関与するとき、水の活量を1とする。
・ 気相や液相反応で固体が存在するとき、その固体の活量を1とする。
・ 気相反応で液体が生じるとき、その液体の活量を1とする。
//////////////////////////////////////////////////////////////////////////