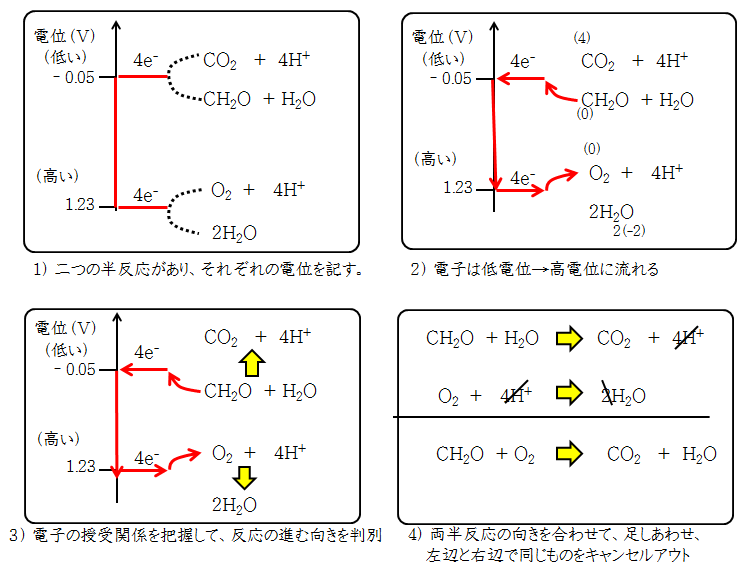
各半反応式の標準電極電位を比べると、どのような酸化還元反応が起こるか、だいたい予想できます。これは、「マイナス電荷の電子は、電位の低い方から、高い方へ流れる」という自然法則に基づきます。
以下に、二つの半反応があったとき、どちらから、どちらへ電子が受け渡されるか(反応の進む向き)が分からない状況から考えます。反応の進む向きと、全反応式の記述の仕方を1)~4)の順で説明します。
1)二つの半反応を上下に記し、それぞれの標準電極電位を縦軸に記す。
2)電子は低電位から高電位を流れる法則に基づき、電子の流れる向きを判別
各元素の酸化数を記し、電子の流れる量を記す。電子を授受する物質を判別
3)各半反応の進む向きを矢印で記す
4)両半反応で原形を左辺、生成形を右辺に配置して、両半反応を足し合わせる。左辺と右辺で同じ物質があるときは、キャンセルアウトする。