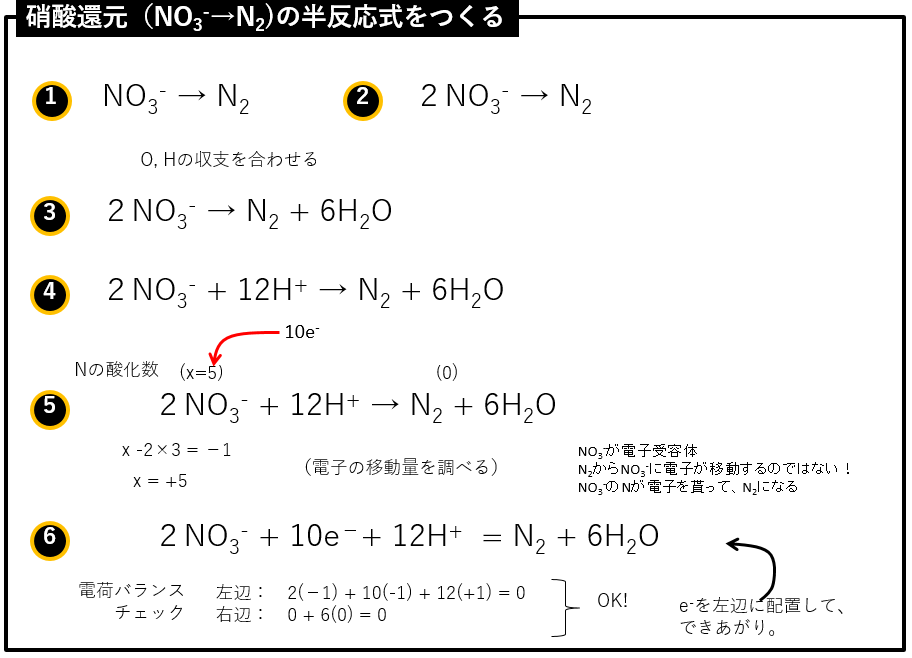
半反応式の作り方(硝酸呼吸の例)
硝酸呼吸(硝酸還元)の半反応式を作ります。酸素呼吸の半反応にて、有機物(ホルムアルデヒド)が酸化される半反応式は共通なので、以下では硝酸還元の半反応式だけを導きます。
硝酸が還元されて、窒素分子(N2)になる半反応です。
① NO3-が還元されてN2になる半反応式を求めたい。それを→で結ぶ。
② 両辺のN量を合せる
③ O, Hの収支を合わせる。まず、Oをあわせるため、右辺に6H2Oをおく。
④ つぎに、Hを合わせるため、左辺に12H+をおく。
⑤ 電子の移動量を調べるため、Nの酸化数を記す。NO3-のNの酸化数をxとおいて求める。N2のN酸化数ゼロから、2NO3-のN酸化数+5に変化するので、電子の移動量は2(5e-)である。
⑥ 移動する電子量(10e-)を加える。左辺と右辺の電荷バランスをチェックする。両辺ともに0なのでOKである。(仮に10e-を右辺におくと、左辺の電荷が+10、右辺が-10になり、バランスしないので誤りであることがわかる)e-が左辺にくるように、両辺入れ替えてイコールで結ぶ。(上のケースでは、元々左辺にe-が配置されているので、入れ替え無し)