下の北海道沿岸 300 mの海底堆積物のコア(円柱状)サンプルをガラス管に封入して保管したものです。堆積物の表面 1 cmくらいの層は、緑茶色を呈しています。これは、表層で生産された植物プランクトン由来の有機物粒子が豊富に含まれているからです。その直下に黒色の層がみえます。この黒色堆積物を採取して塩酸を添加すると泡が発生しました。この発砲気体を塩化鉛(PbCl2)の硫化水素検知管に通したところ、高濃度の硫化水素が確認されました。

なぜ、表面まで硫化水素を発生させる黒色堆積層が至らないのでしょうか。底層海水には酸素が含まれていて、堆積物表面に供給されます。堆積物表層では、酸素呼吸をする微生物が新鮮な有機物粒子を呼吸で分解しています。この酸素を有する堆積物表面層が、下方からの硫化水素の浸出をブロックしてくれているのです。硫化水素は、酸素と出会うと、比較的速やかに酸化されて硫酸イオンに戻るからです。(この硫化物酸化も、バクテリアの作用で速やかに進むと考えられています)
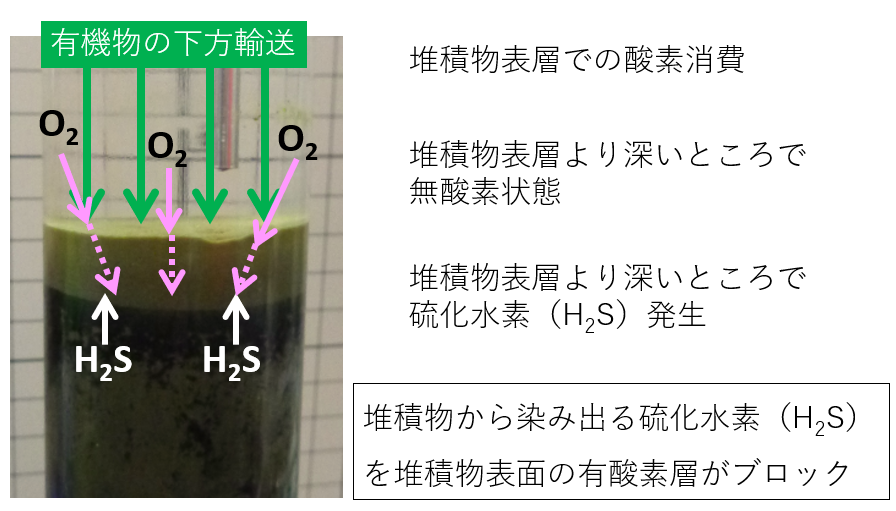
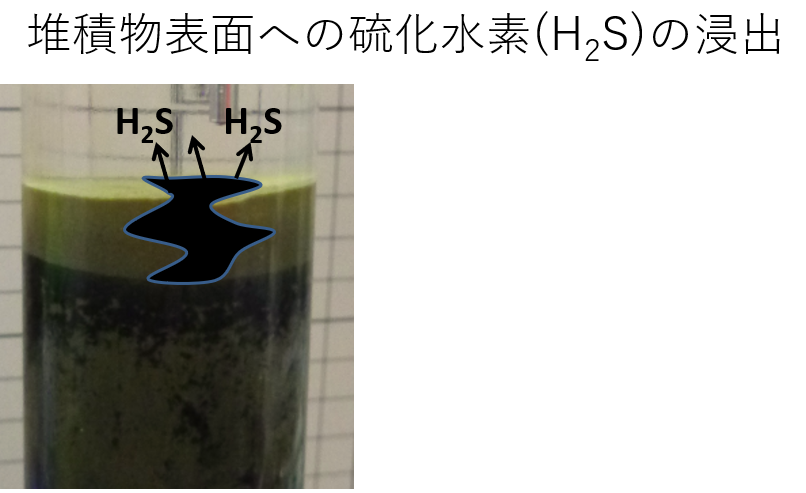
外洋に面した北海道沿岸なので、底層海水には定常的に酸素が供給されているので、堆積物表面までは硫化水素が浸出しません。東京湾など、内湾で有機物粒子の供給が著しい海域では、堆積物表面まで硫化水素が滲出することがあります。
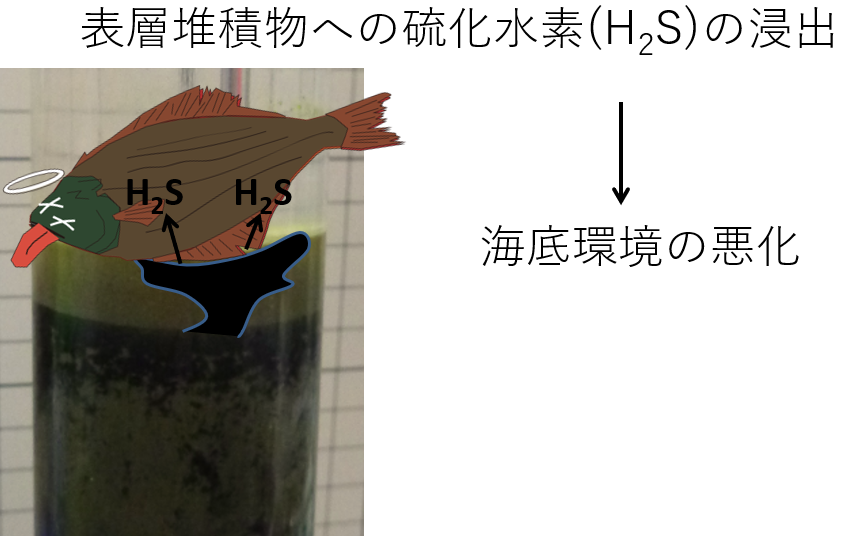
硫化水素は、多くの生物にとって猛毒なので、堆積物表面および底層水に硫化水素が滲出すると、生態系に大きなダメージを与えます。