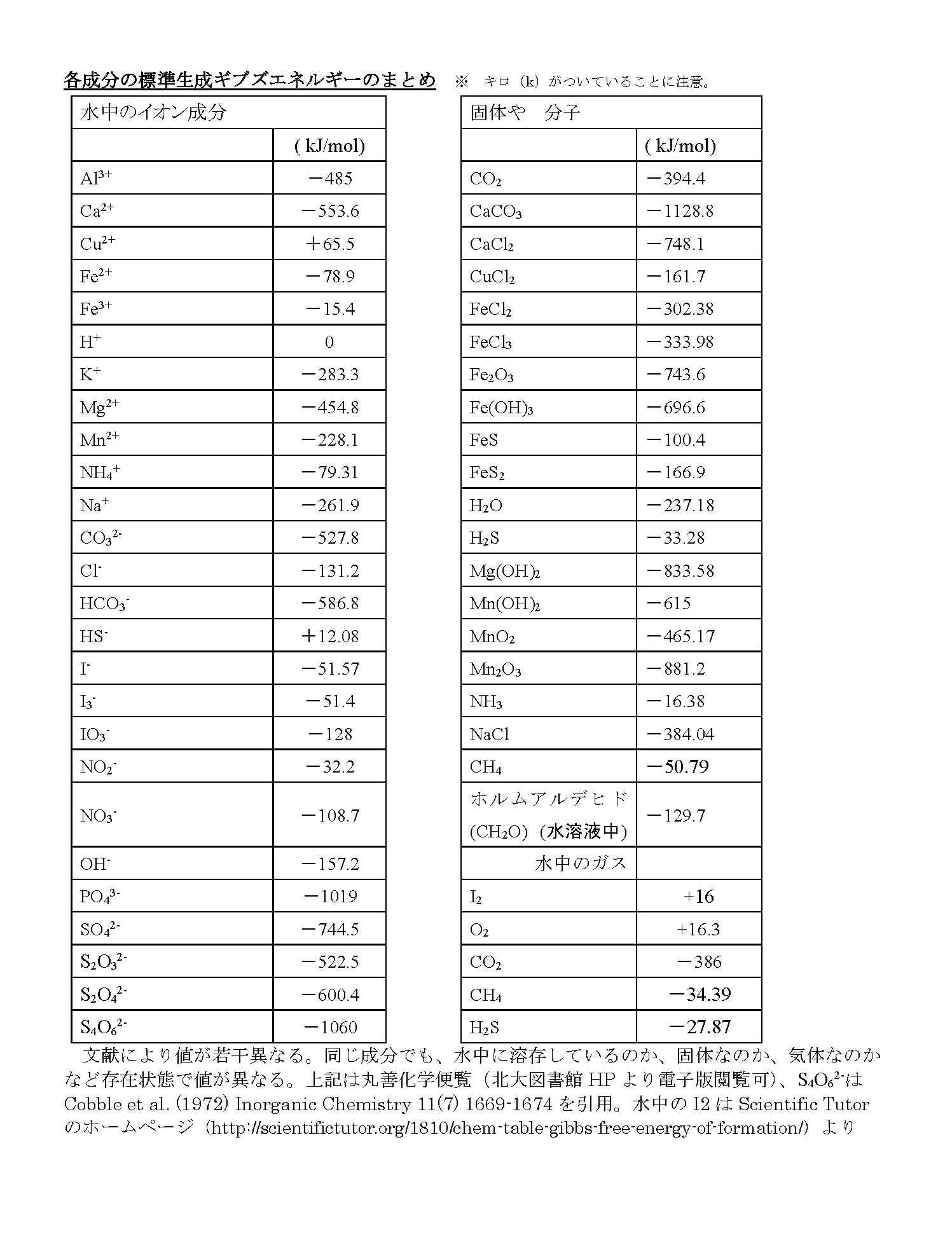
まず、生物代謝で身近な化合物の二酸化炭素(CO2)の標準生成ギブズエネルギーを考えます。CO2を構成する元素は炭素(C)と酸素(O)です。それぞれの元素が単体で安定する状態は、炭素の単体(C)と酸素分子(O2)です。CとO2から1モルのCO2を生成するのに要するギブズエネルギーがCO2(気体)の標準生成ギブズエネルギー(※)で-394.4 (kJ/mol)です。これは実験値として報告されたもので、化学便覧などに掲載されています。
※標準状態において、物質を構成する元素の単体から、その物質を合成するのに必要なエネルギーが標準生成ギブズエネルギーです。反応物質が単体の場合、その標準生成ギブズエネルギーはゼロです。下の例では、炭素(C)と酸素(O2)はゼロになります。
下の絵で記しているように、
【反応前後の標準生成ギブズエネルギーの合計差】=【反応後の物質の標準生成ギブズエネルギーの合計】-【反応前の物質の標準生成ギブズエネルギーの合計】
を計算します。この合計差が化学反応で得られるエネルギーです。各物質には、利用できない束縛エネルギーが内在しています。反応前後の束縛エネルギーを除いた分が、仕事として利用できるエネルギー(=自由エネルギー)なのです。そのエネルギーを使って、化学結合を組みなおす仕事に利用するのが化学反応です。
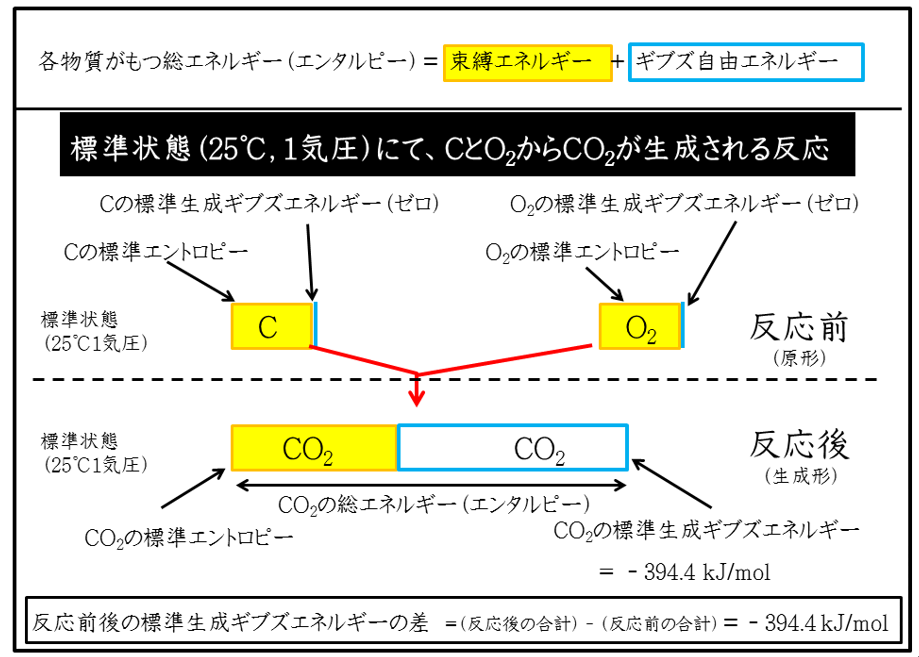
(なぜマイナス符号がついているのでしょうか? CとO2を結合させると(黒炭を燃やすと)熱が発生するように、その系(CO2生成反応)からみると、エネルギーを失う方向だからです)
以下に、海洋堆積物の化学で扱う酸化還元反応にでてくる物質の標準生成ギブズエネルギーを示します。皆さんが研究などで計算に使うときは、化学便覧や引用文献を確認してください。