5-1.粒子間に働く静電気的反発力
5-1-1.粒子の表面電荷
液相と接する固相や気相の界面は負に帯電していることが多い。これは,陽イオンの方が水和されやすく,液相で安定化するためである。無機物だけでなく有機物の表面も中性pH以上で負に帯電する。微生物の場合は,表面のカルボキシル基やリン酸基が負電荷,アミノ基やイミダゾル基などが正電荷の要因となる。そのため,アミノ基やイミダゾル基が電荷を失うアルカリ性域で全体が負電荷,カルボキシル基やリン酸基が電荷を失う低pHで全体が正電荷をもち,同じ表面電荷の同種粒子間に「静電気的反発力」が働く。
5-1-2.電気二重層
負に帯電した固体表面には陽イオンが引きつけられる。一方,水中の微粒子はブラウン運動をしているので,粒子表面近傍の正電荷は,表面に近いほど密度が高い拡散分布となる(Gouy-Chapman拡散二重層モデル)。
Φ 粒子表面から距離Lにおける電位,Φ0 表面電位,κ Debyeパラメータ
距離L = 1/κは「電気二重層の厚さ」とよばれ,液相イオン強度が高くなると,1/κが小さくなる。これを「電気二重層の圧縮」という。
5-1-3.電気二重層によって生じる反発力
同じ電荷とサイズの球形粒子間に働く静電気的反発力VRは,
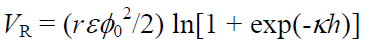 (5-2)
(5-2)
r 粒子の半径,h 粒子間の距離,ε 液相の誘電率
5-2.粒子間に働く引力(van der Waals力)
物質を構成する分子の間にはvan der Waals引力が働く。van der Waals引力は以下の三つの力からなる。
1) 双極子間引力:分子内の電子分布が非対称な分子が永久双極子となって働く引力
2) 誘起効果:永久双極子をもつ分子に隣接する分子が分極して働く引力
3) London分散力:極性が小さく永久双極子をもたない分子間に働く普遍的な分子間引力。分子間距離の7乗に反比例する近距離引力であるが,コロイドサイズの分子集合体の場合はかなり遠距離に及ぶ