DO瓶に塩酸を入れて沈殿を溶解させると、溶存酸素量に応じて、ヨウ素分子(I2)が発生しています。
このヨウ素分子(I2)の量を濃度がわかっているチオ硫酸ナトリウム溶液で滴定して調べます。
ヨウ素分子が溶液に存在すると(※)、その溶液は褐色~黄色を呈します。
ヨウ素分子にチオ硫酸を滴下すると、ヨウ素分子(I2)が還元されてI-に戻ります。色がなくなったところが終点(I2を消すのに必要なチオ硫酸の滴下が終わった点)です。
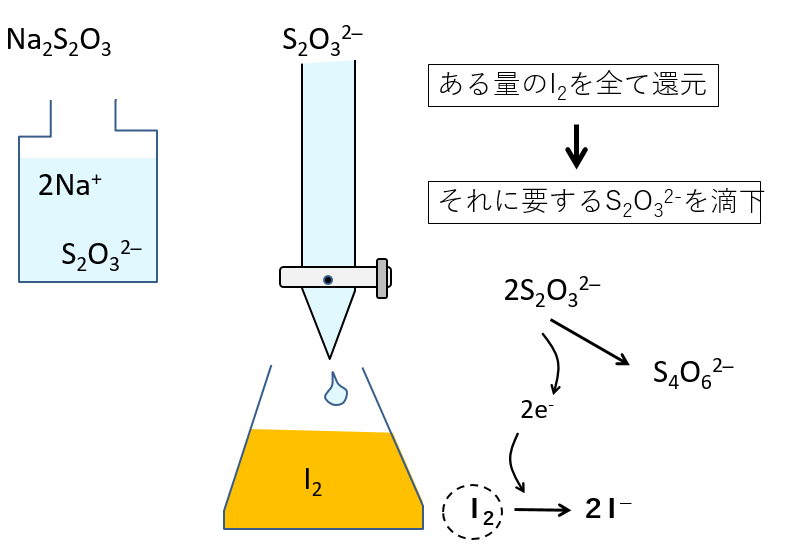
※ ここで注意したいのは、ヨウ素分子(I2)は難溶性の黒色の固体であることです。下の図のように、I2は周囲にI-があれば結合して三ヨウ化物イオン(I3-)として溶存するのです。滴定に供する褐色液体の”褐色の正体”は、三ヨウ化物イオン(I3-)なのです。I2と三ヨウ化物イオン(I3-)は平衡状態にあるから、三ヨウ化物イオン(I3-)の色がなくなると同時に、I2もなくなります。
なお、ウインクラー法を手分析でやるときは、褐色が薄くなったヨウ素液(試料水)にデンプンを入れて、ヨウ素デンプン反応により薄紫色をつけます。これの方が、色の濃淡が顕著にでるので、終点を判別しやすいのです。
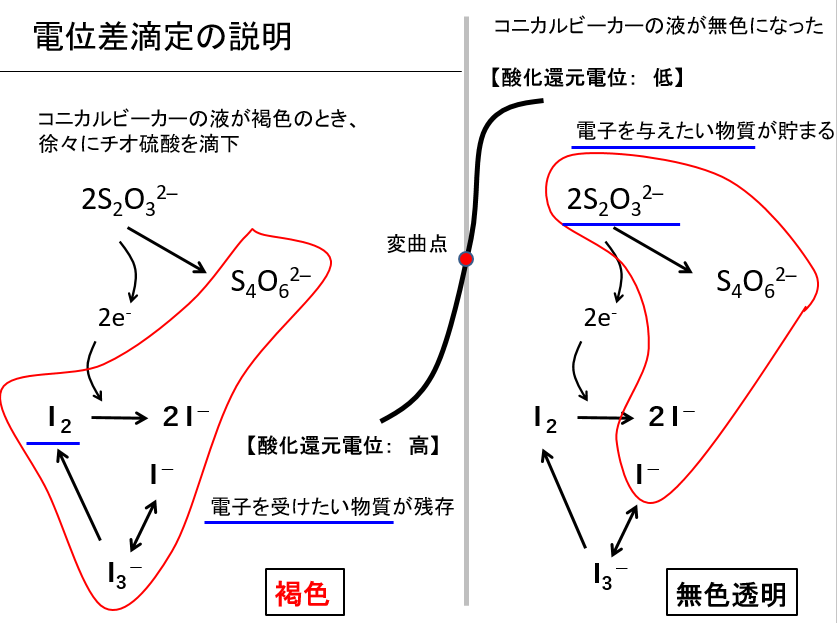
電位差滴定により、試料水をチオ硫酸で滴定する自動装置もあります。以下に、電位差滴定の概要を示します。
電位差滴定では、チオ硫酸で滴定しながら、試料水中の酸化還元電位をモニターします。終点前(試料水にヨウ素分子があるとき)と終点後(チオ硫酸がたまるとき)では、酸化還元電位が違います。その終点は、電位曲線の変曲点となります。その変曲点を読み取って、終点に至るまでのチオ硫酸溶液の滴下量を読み取ります。