//////////////// 化学平衡の基本式(復習) /////////////////////////
【原形】 【生成形】
aA +
bB + … ⇆ xX
+ yY + …
平衡状態においては、以下の関係が成り立ちます。
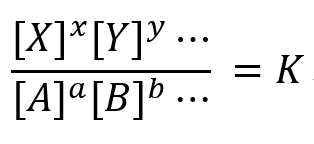
Kを平衡定数とよび、この関係を質量作用の法則といいます。
[A],
[B], [X], [Y]はこの反応の平衡濃度、a, b, …, x, y, …は反応モル比です。
ここで、
原形を構成する各物質の標準生成ギブズエネルギーの合計:ΣGf0原形
生成形を構成する各物質の標準生成ギブズエネルギーの合計:ΣGf0生成形
として、
反応前後における(生成形と原形を構成する物質の)標準生成ギブズエネルギーの合計差をとると、
⊿∑Gf0生成形-原形 = ΣGf0生成形 - ΣGf0原形
この反応が平衡状態にあれば、以下の関係を満たします。
⊿∑Gf0生成形-原形 = -R・T・lnK
//////////////////////////////////////////////////////////////////////////