また、硫化水素イオン(HS-)は、硫化水素(H2S)と解離平衡にあります。
硫化水素と硫化水素イオンの解離平衡の反応式
H2S (aq) = H+ + HS- ;K = 10-7 (Kは、解離平衡定数)
この反応でSの酸化数は-2価で変わらないので、これは酸塩基反応である。したがって、この解離平衡の条件において酸化還元電位は関係ありません。平衡定数とpHの関係は以下の式で表されます。
平衡定数 = {生成形の濃度積} / {原形の濃度積} だから、
[HS-][H+]
/ [H2S]} = 10-7
両辺Logをとって、水素イオン濃度をpHで表します。
Log{ [HS-] / [H2S] } - pH = -7
HS-とH2Sが同じ比率で共存する平衡条件:[HS-] / [H2S]
= 1 はpH = 7のときです。
pH7以下では、ほとんどが
H2Sとして存在し、
pH7以上であれば
HS-として存在することになります。この情報を加えて、先の図を書きなおしました。
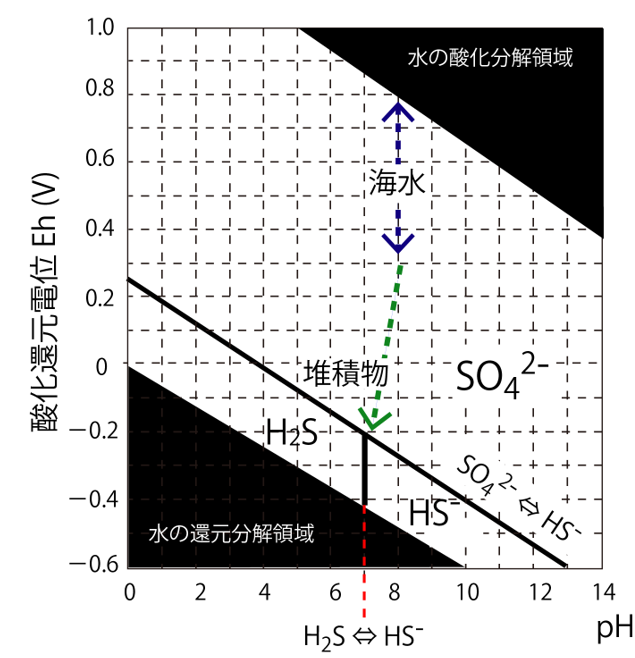
これを、物質の化学形態がpHと酸化還元電位で変わることを表す、“プールベ図”といいます。「水の酸化分解領域」と「水の還元分解領域」では、H2Oが分解してしまう領域のため、水環境では存在しえない領域です。
繰り返しになりますが、プールベ図で記した境界条件は、熱力学定数から計算した結果であり、微生物の作用により、より酸化的な環境(-
0.1 (V)くらいから)でも硫酸還元が進むことが確認されています。