呼吸は酸化還元反応です。
酸化還元反応とは、物質間で電子の移動がある化学反応です。
電子が移動するのは、電位差があるからです。つまり、電子をやり取りする物質に電位が生じています。
その酸化還元電位を求めます。
酸素呼吸の半反応式を下に記します。
⊿Gf0 (kJ/mol)
①: CO2
+ 4H+ + 4e- = CH2O + H2O +18.12
②: O2
+ 4H+ + 4e- = 2H2O -490.66
酸素、二酸化炭素、ホルムアルデヒド、水が混在する状況で、どれが酸化剤、還元剤になるか定まっていません。つまり、どれが電子を受け取るのか、与えるのかわかりません。半反応だけでは、電子が宙ぶらりんな状態なのです。宙ぶらりんで、見かけ上、電子の移動が無い平衡状態だと思ってください。半反応の平衡状態における電位を、その半反応の標準電極電位とよびます。(細かいことは気にせず、以下のように覚えておけばよいです)
標準電極電位は、以下の手順で求めます。
1) 半反応式の物質の下にギブズの標準生成ギブズエネルギーを記す
2) 半反応式の電子の下に、電子のエネルギーを記す。
電荷量(C) ×電位(V) = エネルギー(J) です。V = J/C でもあります。
1 molの電子の電荷量の絶対値は、ファラデー定数(F = 96485 C/mol)で表されます。
(電子はマイナス電荷なので、エネルギーにマイナスをつける)
この電位(V)が、今求めたい標準電極電位E0です。
3) 半反応式の左辺と右辺のエネルギーをイコールで結んで、E0を求める。
計算してみれば簡単です。
①: CO2 + 4H+ + 4e- = CH2O + H2O
G(kJ/mol) -386 0 -129.7 -237.28
-4×E0×96485
左辺:-386×1000 - 4E0×96485
右辺:-129.7×1000 -237.28×1000
左辺=右辺 より、 E0 = ( -129.7 - 237.28 + 386 )×1000 / (-4×96485 ) = 0.049 (V)
①の半反応の標準電極電位( E0 )は 0.049 (V)です。
E0 = ⊿Gf0 / (-nF)
⊿Gf0 :【右辺の物質の標準生成ギブズエネルギーの合計】
-【左辺の物質の標準生成ギブズエネルギーの合計】
と表してもよいです。
同様に計算すれば、
②:O2 + 4H+ + 4e- = 2H2O E0 = 1.23 (V)
一つ前のコースで記した、硝酸~硫酸呼吸の半反応についても、以下のように標準電極電位を計算しました。
③4NO3- + 24H+ + 20e-
=
2N2 + 12 H2O E0
= 1.25 (V) ←実際にはない
NO3-
+ 2H+ + 2e- = NO2-
+ H2O E0 = 0.83 (V)
④SO42- + 10H+ + 8e-
=
H2S + 4H2O E0 = 0.30 (V)
④’ SO42-
+ 9H+ + 8e- = HS- + 4H2O E0 = 0.25 (V)
⑤CO2 + 8H+ + 8e- = CH4
+ H2O E0 = 0.16 (V)
電子は、電位が低いところから、高い方へ流れるのが自然法則です
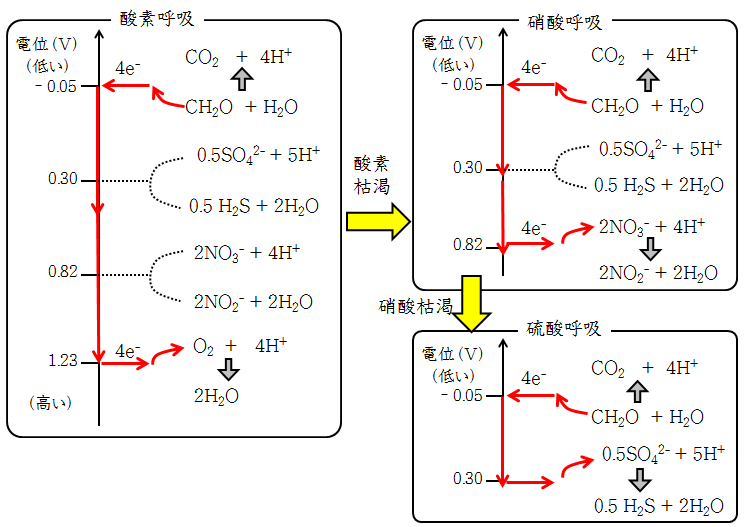
下の図に、ある水環境中に有機物(ホルムアルデヒドとする)があり、各種酸化剤(酸素や硝酸、硫酸)がある場合、ホルムアルデヒド(CH2O)の炭素原子から放出された4つの電子が、どの酸化剤に受け渡されるのかを示しました。
下図(左)のように、硫酸と硝酸、酸素が混在するとき、電子は最も低電位の有機物酸化の半反応①から、最も高電位の半反応(酸素)に流れます。そのとき電子が硫酸還元や硝酸還元の半反応は素通りします。
酸素が枯渇すると硝酸還元が起こります(下図の右上)。そのとき、周囲に硫酸があっても、電子は高電位の硝酸の半反応に流れます。
硝酸も枯渇すると硫酸還元が起こります(下図の右下)。④式では硫化水素(H2S)発生の半反応を記し、④’では、硫化水素がH+を放出して硫化水素イオン(HS-)になった状態を記しました。(のちに説明しますが、pH7以上ではH2Sではなく、HS-が安定に存在します)